
2023年8月
抗体の未知なる可能性を引き出し最大化させる革新的な技術
~抗体を基点に検査薬の未来を変える~(前編)
今回は、分子化学系の熊田陽一准教授の研究について紹介いたします。熊田准教授は、検査薬で使われる抗体の研究・開発に取り組んでおられますが、そこには誰も見たことがない革新的な技術が使われているようです。この技術を使うことで、現在の検査薬におけるあらゆる問題を一度に解決することができるとおっしゃっています。
そこで今回は、前編と後編の2回に分けて、技術の革新性とその面白さに迫っていきます。
前編では、これまで常識とされていた方法とは全く違うアプローチで、どのようにして「理想の抗体」を作るのか、その技術の概要や根本的な考え方をメインにお届けします。
誰も見たことがないアプローチで、抗体の常識を覆す
私が研究している抗体は、これまでの抗体とは一線を画すものだと考えています。「抗体」と聞くと、同分野の研究者の方は、マウスやウサギなどのいわゆる実験動物から作られる抗体をイメージされるかもしれません。
しかし、私が研究開発している抗体は、言葉は同じであったとしても、製造手法や抗体そのものの性質がまるで違っています。何が一番大きく違うのかというと、
これまでの抗体
これまでの実験動物から作られる抗体は、抗体そのものを改変することができないので、一度作った抗体の形やサイズはもちろん、性質についても一切手を加えることができませんでした。検査薬を作るにあたり、その抗体がたとえ検査に望ましくない状態であったとしても、そのまま使う以外方法がありませんでした。結果として検査の不安定さを生む原因となります。当初、コロナウィルスの抗原検査の結果が安定しなかったのはこのためです。
新しい抗体
これに対して、我々の研究室で作っている抗体は、抗体そのものの構造や性質を自由自在に改変することができます。抗体のサイズを自由自在に大きくしたり小さくしたり、容姿そのものを変えたり、さらには抗体自体の溶解性や安定性など、全てを自由自在に設計することができ、そこには限界がありません。抗体という言葉は同じでも、その特徴やできることが全く異なっているのです。
検査薬の限界をいくらでも超えていける
抗体のあらゆる要素を何度でも設計し改変、改善できるので、より良い抗体へとイノベーションを起こし続けることが可能になるのです。たとえば、抗原をキャッチする能力がとても優れているのに、保存機能や安定性に問題がある抗体があるとします。これまでの実験動物で作られる抗体では、これ以上新しい機能を付け加えることができませんでした。ですが、私が作っている抗体は、安定性や保存性を著しく下げてしまっている抗体の一部を別の優れた抗体の部分に組み替えるなどをして、抗体そのものの性質を改変できます。
このように性質そのものを、自由自在に変えていくことで、理想の抗体を作り上げられます。他にも、抗体の一部を改変することで、低コスト化を図ったり、熱に強い抗体をつくったり、別の抗原と結合する抗体を生み出すなど、様々な機能強化を図れます。つまり、これまでの抗体にあった限界を何度でも突破することができるということです。
以下のグラフをご覧ください。こちらは、大腸癌マーカーのテスト結果です。
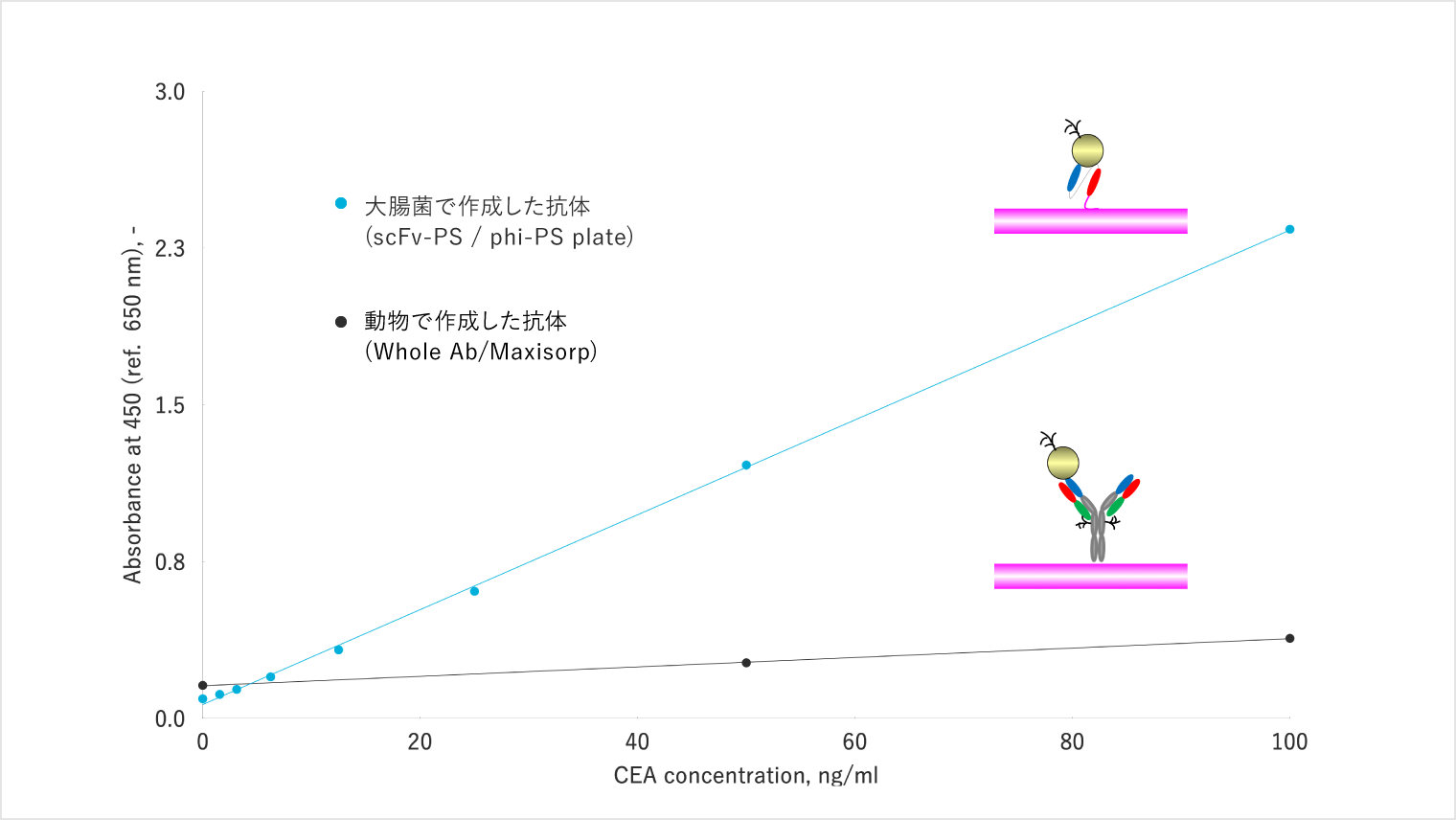
黒線は動物から作られたこれまでの抗体、青線は私が研究をおこなっている大腸菌から作られた抗体を使った結果です。縦軸が抗体のパフォーマンスだとすると、動物由来の抗体と大腸菌由来の抗体では10倍以上、パフォーマンスに開きがあることがわかります。
これは、意図的にパフォーマンスが上がるように私たちが抗体を改変しているからに他なりません。これが抗体を分子改変することで起こせるインパクトなのです。この分子改変技術は、抗体を作る以下の過程の中の2番目および3番目で活用することになります。
<抗体を作るプロセス>
1.発見 :検査に最適な抗体を単離する
2.改良 :単離した抗体を分子改変しパフォーマンスを向上させる
3.固定化:固定化力を促進する新しいタンパク質を開発する
4.量産 :大腸菌を使って低価格で良質な抗体を大量生産する
ここからは、この順番に沿って私の抗体研究を解説します。あわせて、研究の中で発見した「知られざる抗体の性質」などその面白さについても、お届けします。
【1】発見:検査に最適な抗体を単離する
抗体のデザインを改変する前に、まずはその土台となる優れた抗体を見つけ出す作業から始まります。例えば、糖尿病を発見することを目的とした検査薬を作る場合は、糖尿病の指標となる抗原(バイオマーカー)をキャッチすることにおいて1番パフォーマンスの高い抗体を探すところからスタートします。
作業としては、
①1億種類以上の抗体ライブラリーから優良な抗体100種類の選別
②その100種類の抗体をあらゆる視点から分析し1つに絞り込む
という手順になります。
まずは、私たちが持っている1億種類ほどある抗体ライブラリーのなかから抗原に結合する可能性のある抗体をファージディスプレイという技術を使って100種類まで絞り込みます。
面白いのはここからです。
次に、選出した100種類から最も優秀な1つの抗体に絞っていくのですが、この過程で思いもよらない発見や可能性と出会うことができます。絞っていく目的は「対象としている検査で一番成果を発揮する抗体を見つける」ことにありますが、評価基準は抗体の抗原に対する結合力だけではありません。様々な観点から抗体を観察・分析していきます。
たとえば、一見似たような構造を持つ2つの抗体があったとしても、その中身を研究していくと、それぞれ対局にある性質を持っていることがわかったり、パッと見た時は、あまりにも平凡な抗体であるため対象外だと判断してしまうような抗体であっても、観察をしているうちに、実は特定の性質において突出したパフォーマンスを出せることが分かったりすることがよくあります。
抗体の発掘作業のなかで、これまでの抗体研究の常識を覆すような抗体と出会うことがたくさんあるため、いろんな可能性を考えながら検証していかなくてはなりません。それらを調べながら、抗体にランクをつけて最終的な評価をしていきます。
以下の表を見てください。これは、1億種類の抗体ライブラリーの中から選出した約100種類の抗体です。
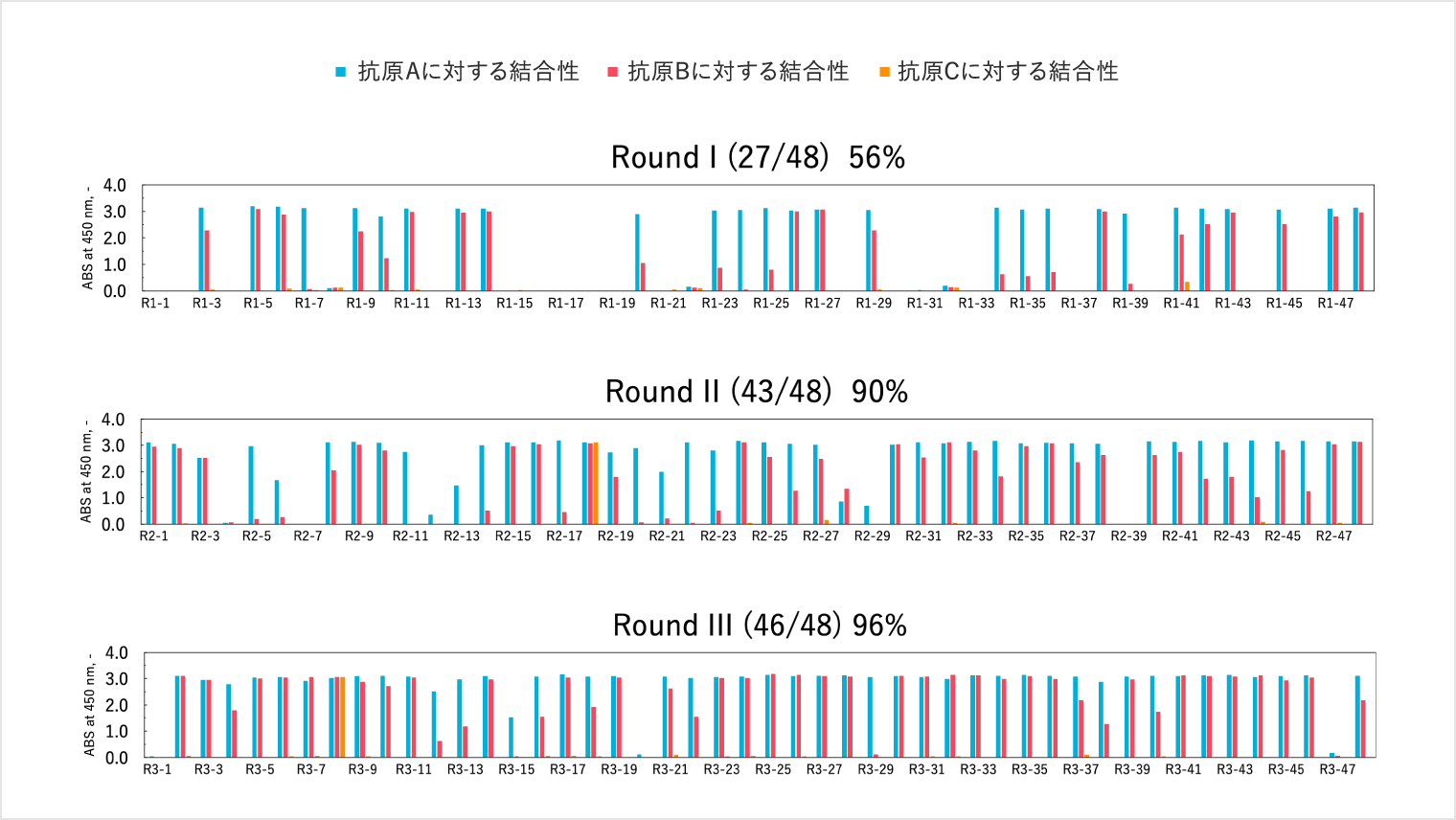
1番左上から「R1-1」「R1-2」と順に抗体のクローンが並んでいて、各抗体の上に、青と赤色の2本の棒グラフが立っているものや、どちらか1本の棒グラフが立っている抗体が並んでいます。
青と赤色の2本の棒グラフが立っているということは2種類の抗原をキャッチできるサインです。これらが通常の抗体の形です。ですが、よく見てみると、この中に特異な性質を持つ抗体があるのがわかります。2段目、3段目のそれぞれに、赤と青の他に緑色の棒グラフを持つ抗体があるのが分かるでしょうか。
これは、通常の抗体とは違う特質を持った抗体です。棒グラフが3本あるということは、3つの抗原をキャッチする性質を持っているということです。これは面白いと思い、この抗体を分析しランキングに落とし込んでみると、さらに面白い結果が見えてきます。
なんと、この3つの抗原をキャッチする抗体が結合力のランキングで1位になったのです。検査において非常に高い結合力を発揮する抗体だということです。
一見、変に見える抗体であっても、1つ1つのクローンと向き合い、じっくりと観察をすることで、とんでもないポテンシャルを発見することがよくあります。この過程を通して、検査感度が高い抗体をたった1つに炙り出していきます。
これで、理想の抗体を作る準備が整いました。
【2】改良:抗体を分子改変しパフォーマンスを飛躍させる
分子改変について
1億種類のライブラリーのなかから1つの抗体に絞ったなら、次はその抗体を分子改変する段階に入ります。これが、記事の冒頭でお伝えした抗体を自由自在に改変する技術にあたります。1億種類から選び出した抗体は、抗原と結合する機能が突出して優れていますが、その分マイナス面も存在している可能性もあり、そのまま検査薬として使えるケースはほとんどありません。大抵の抗体は、以下のような問題のいずれかまたは複数抱えています。
・ 大量生産するのに向いていない
・ 液中で凝集してしまう
・ 分解されやすい
・ 基板材料の上で結合能を失う
この他にも、多くの問題を抱えているケースがほとんどです。ここからが私たち研究者の腕の見せ所です。
抗体が持つ「抗原に結合する能力」はそのまま残し、上記の欠点を克服できるように分子改変を行います。その結果、抗体の性質が変わっていき、検査薬として完璧な抗体へと昇華させていくのです。
この分子改変について、どのように行うのか解説します。
抗体の弱点を克服するフレームスイッチング テクノロジー
以下の抗体の図解をご覧ください。
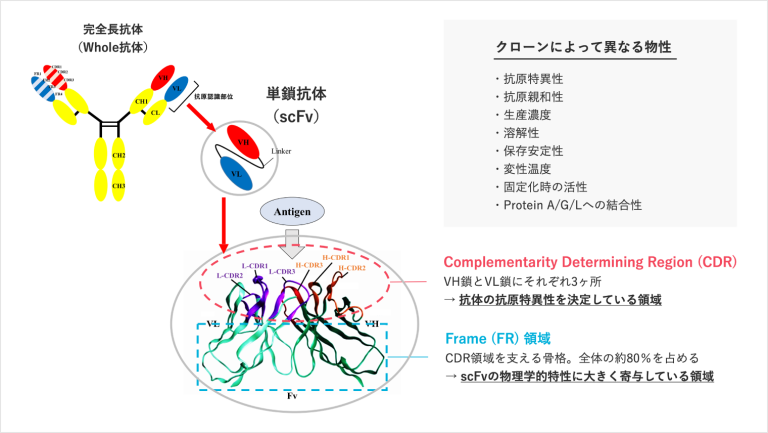
私たちは抗体を、抗原と結合する結合部(上部分)と下のフレーム(土台部分)の2つに分けて考えます。この結合部(上部分)とフレーム(土台部分)を分子改変しながら理想の抗体作りを行います。
たとえばインフルエンザの検査薬に適した抗体を作ることを目的にAという抗体を見つけたとします。しかし、このA抗体を調べてみると、抗原と結合する能力は高いのに、生産能力が低く、大量生産ができないことがわかったとしましょう。
この場合、フレーム部分を別の生産能力が高い抗体のフレームと入れ替えることで、生産能力を向上させることができます。すなわち、別の抗体のいいところを移植することで、弱点を克服することができ、その結果、理想の抗体を作ることが可能になるのです。
以下のグラフをご覧ください。これは、3つの抗体の生産量を比較したグラフです。
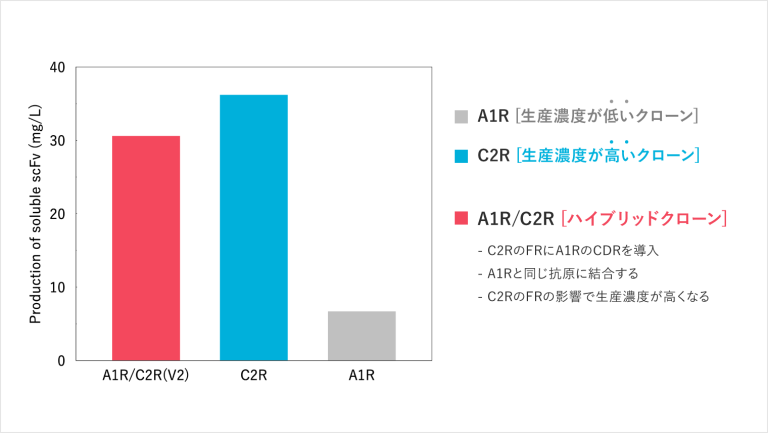
一番右側の抗体A1Rは先ほどお伝えしたインフルエンザの抗原と結合する抗体です。見ての通り、生産能力が低いことがわかります。一方、その隣にある抗体C2Rは、抗体A1Rよりも生産量が高いことがわかります。この場合、生産能力が高い抗体C2Rのフレームを抗体A1Rのフレームと入れ替えて、生産能力が高い抗体を生み出すことができないかと考え、分子改変を行います。
その結果、新たに生み出された抗体が一番左にある抗体A1R/C2Rです。いかがでしょうか。最初の抗体A1Rに比べて生産能力が飛躍的に向上していることがわかります。抗原と結合する能力はそのまま維持し、フレームだけを別の抗体のフレームに取り替えることで、生産能力を5倍以上伸ばすことに成功しています。
抗体のフレームを分子改変して理想の抗体を作る
抗原に強く結合する抗体を見つけたとしても、それが検査薬として理想の抗体であることはごくごくまれです。特に、基盤材料への固定化力が弱いケースや、固定化後に抗原に対する結合力が極端に弱くなる抗体も今までたくさん見てきました。
そこで、私たちはフレームスイッチングという技術を活用して、抗体の固定力を高める研究をしています。前項で、抗体を結合部とフレームに分けて、別の抗体の良い部分と入れ替えながら、理想の抗体を作るというお話をしましたが、このフレーム部分を入れ替える技術こそがフレームスイッチングです。分子改変を行い、抗体のフレームを、固定化に優れている別の抗体のフレームと入れ替えます。
どの抗体のフレームと取り替えれば固定化を促進できるのか。このベストマッチングを見つけるために、様々なフレームを入れ替えながら何度も検証実験を繰り返します。それは、抗体が本来持ち合わせている性質に加え、ポリスチレンやニトロセルロースなど、どの材料基板を使うかによって、ベストな組み合わせは都度変わるからです。
このベストマッチングを見つけ出すために、固定化に優れている抗体の発見とその理解が欠かせませんし、材料基板そのものへの深い理解も大切です。
また、フレームスイッチングを使えば、固定化や結合力向上以外にも、熱に強い抗体を生み出せたり、保存性や疎水性、生産量を向上させるなどの様々な機能を付け加えたり、強化したりできます。抗体の性質を自由自在に操れるので、抗体が持つあらゆる欠点の克服が可能となるのです。分子改変の特徴は、なんといってもこの自由度の高さにあります。また、そこには限界がありません。
たとえばフレーム部分ではなく、結合部を入れ替えれば結合する抗原を変えることができ、別の検査薬へと変えることすら可能になります。私たちの抗体への理解度とアイディアしだいで、理想の抗体をどんどん生み出せますし、そのパフォーマンスも更新し続けられるということです。
このように、分子改変の技術を使うことで、様々な抗体の良い部分を取っ替え引っ替えしながら、理想の抗体を作っていくことが可能となるのです。
(後編に続く)
研究者プロフィール

主な発表論文・関連特許
Strategies for selection and identification of rabbit single-chain Fv antibodies as ligand in affinity chromatography
著者名 : Y. Kumada*, H. M. Rakotondravao, Y. Hasegawa, Y. Iwashita, H. Okura,S. Uchimura, J. Horiuch
掲載誌名 : Journal of Bioscience and Bioengineering
出版年月 : 2022年09月
巻・号・頁 : 134, 233-239
Efficient and robust isolation of rabbit scFv antibodies using antigen-coupled multilamellar vesicles
著者名 : Yoichi Kumada, Yuya Hasegawa, Jun-ichi Horiuchi
掲載誌名 : Journal of Bioscience and Bioengineering
出版年月 : 2021年03月
巻・号・頁 : 131(3), pp. 299-304
Design and site-directed immobilization of single-chain Fv antibody to polystyrene latex beads via material-binding peptides and application to latex turbidimetric assay
著者名 : Yoichi Kumada, Yohei Miyamura, Reina Tanibata, Koichi Takahashi,Shinya Ogasawara, Fumio Gondaira, Jun-ichi, Horiuchi
掲載誌名 : Journal of Bioscience and Bioengineering
出版年月 : 2021年01月
巻・号・頁 : 131(1), 84-89
Site-Specific Immobilization of Recombinant Antibody Fragments through Material-Binding Peptides for the Sensitive Detection of Antigens in Enzyme Immunoassaysssay
著者名 : Y. Kumada
掲載誌名 : Biochimica Biophysica Acta
出版年月 : 2014年07月
巻・号・頁 : 1844・pp.1960-1969
- 産学連携や研究支援に興味がある方(産学公連携推進センターHP)
- 紹介教員にメッセージを送りたい方(メッセージフォーム)
- 大学や学生を支援したい方(基金事業)
- 受験を考えている方(入試情報)
- 大学全体について知りたい方(京都工芸繊維大学HP)




