
2023年9月
抗体の未知なる可能性を引き出し最大化させる革新的な技術
~抗体を基点に検査薬の未来を変える~(後編)
前編では、パフォーマンスの高い抗体を探し出し、その抗体をフレームスイッチング技術を使うことで、さらに高性能な理想の抗体を生み出す技術について解説してきました。後編では、その抗体を実用レベルまで落とし込むための技術についてお届けします。
その鍵となるのは「抗体の固定化」と「安価かつ大量生産できる技術」になります。
【3】固定:固定化力を促進する新しいタンパク質を開発する
ここでは、抗体を固定化する技術について紹介します。
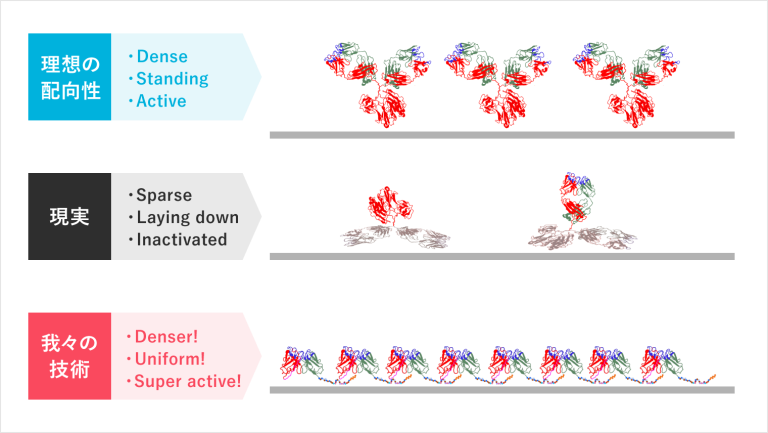
前編でお伝えした抗体を分子改変するテクノロジーは、今からお伝えする「抗体の固定化」のために存在すると言っても過言ではありません。検査薬の抗体は、すべて材料基板に固定化されて使われており「抗体をしっかりと材料基板に固定化できるか」が検査感度の鍵を握っています。どれだけ抗原と結合する優れた抗体を用意しても、その抗体が材料基板から剥がれてしまったり、材料基板の上で横に倒れてしまうと、検査感度は悪くなりますし、精度も落ちます。
つまり、固定化は検査薬の精度に大きな影響を及ぼすファクターなのです。
また、現在の検査薬業界が抱えている大きな課題も固定化にあります。主流である動物由来の抗体は以下のような形をしています。
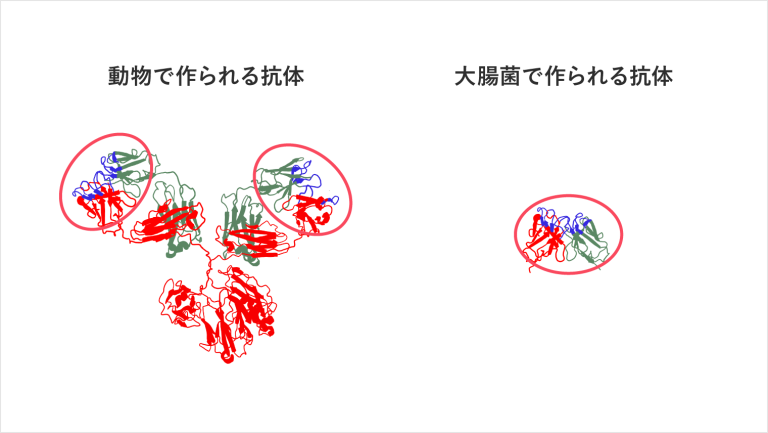
赤丸で囲われた箇所が抗原と結合する部分で、この2つの結合部を1本の足で支えているような状態です。形からもわかるように、基板上に立った状態を維持するには、非常に不安定な構造であり、材料基板の上で倒れやすい状態です。ですので、材料基板の上で抗体の構造が原型をとどめずにぐちゃぐちゃに崩れているケースも多くあります。
また結合する部分以外の不要な部分(上記図解の緑枠部分)があまりにも多いため、密に抗体を敷き詰めることができません。これにより材料基板に固定された抗体の抗原を補足する力はさらに低下してしまいます。
しかし動物由来の抗体では、これ以上抗体を分子改変することができないため、固定化において打つ手がないというのが現状です。では、どのようにして、私たちは抗体の固定化問題を克服したのかお伝えしたいと思います。
材料親和性ペプチドタグを使って、基板と抗体を繋ぎ止める
私が作る抗体は基本的にどれも、動物由来の抗体に比べて非常に小さく安定であり、高密度に綺麗に並べることができるため固定化に適しています。ここから、さらに固定力を高め、基板の上で完全に固定化させるために、新しいテクノロジーを活用します。それが、材料親和性ペプチドタグという吸着領域です。この材料親和性ペプチドタグを使って材料基板と抗体そのものを物理的に繋ぎ止めるのです。
以下の図解をご覧ください、
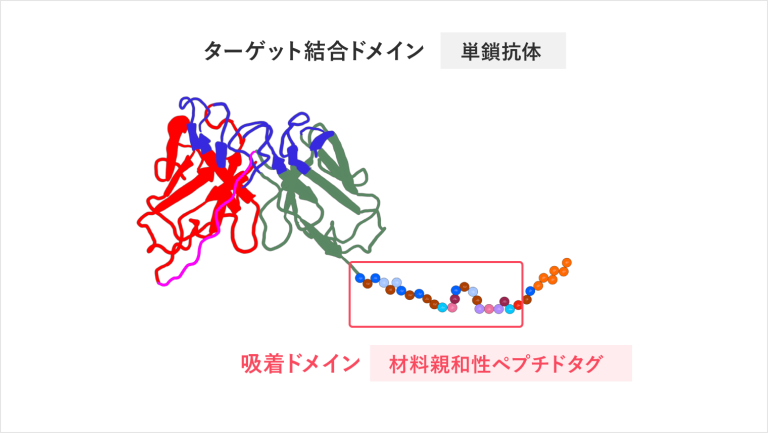
抗体と材料基板が紐状のようなもので繋ぎ止められて固定化されているのがわかります。この紐状のものが「材料親和性ペプチドタグ(以下ペプチドタグ)」になります。このペプチドタグのおかげで材料基板の上で、綺麗に密集させる形で抗体を並べて固定化することが可能になります。
また、形が崩れないように、抗体をしっかり守る役割も果たしてくれます。「ペプチドタグを使って、抗体と基板をつなぎ合わせる」というと、単純な話に聞こえてしまいますが、ここにも非常にユニークな技術が使われています。
1つ目は、自然界にはない「新しいタンパク質」をデザインしている点。
「抗体」も「ペプチドタグ」も、もともと自然界に存在する配列なのですが、「抗体」と「ペプチドタグ」を連結した「タグ付き抗体」は、自然界に存在していない「新しいタンパク質」となります。基板上で抗体がうまく整列するように、タグ付き抗体の分子設計をしています。タンパク質の配列を自在に操作しながら、まだこの世に存在していない新しいタンパク質を生み出しているのです。
2つ目は、あらゆる抗体に対応するため、いくつもの新しいタンパク質を作る必要がある点です。このペプチドタグは、1つ作れば全ての抗体に使えるのかというとそうではありません。材料基板の種類によって、それに適したベストなペプチドタグを開発する必要があります。
たとえば、「材料基板はプラスチック製のプレートにするのか、ビーズ状のものを使うのか」によっても、ペプチドタグの種類や配列を変更する必要がありますし、導入する抗体の物性や分子サイズなど、あらゆる状況を考慮して「ペプチドタグ」の配列を変えながら、「タグ付き抗体」を設計していく必要があるのです。
その上で、設計した「タグ付き抗体」が「水に溶けた状態でもしっかりと形として存在できるのか」「ペプチドタグをつけた状態でも抗体は、抗原と結合する機能を維持できているのか」を検証していく必要があります。
これらは、世の中に新しいタンパク質を生み出す研究であり、従来の抗体研究の域を超えた新しい研究と言えるでしょう。
抗体の固定化を完全なものにするためには、新しいタンパク質をデザインするというタンパク質工学への理解も必要になってくるということです。現在、私の研究において「プレート、ビーズ、メンブレン」など検査薬の材料基板としてよく使われるメジャーな素材については固定化に成功しています。
【4】量産:大腸菌を使って低価格で良質な抗体を大量生産する
ここではポイントの3つ目、抗体を作る技術について解説します。
抗体を大腸菌を用いて大量生産する技術は主に2つ。
・大腸菌を高密度培養して抗体を作る方法
・リフォールディングで抗体を再生させる方法
この2つになります。
大腸菌を高密度培養して抗体を作る
現在の抗体は、動物を使って作られる方法が主流で、日々大量の動物の命が犠牲になっています。ウサギやマウスなどの実験動物の体内に、注射で抗原や細胞を注入し抗体を生成する方法です。莫大なコストが必要になるという以上に、倫理的に大きな問題を抱えています。
かつては私も抗体研究をする上で、たくさんの実験動物を使用していたので、心を痛める時は何度もありました。そんな思いから、「動物以外で抗体を作ることはできないか」と考えるようになり今の研究スタイルに辿り着いたのです。
私が採用しているのは「大腸菌を使って抗体を作る方法」です。優れている点は、これまでかかっていた約8割のコストをカットできること、動物の命を奪うという倫理的な問題も解決できる点です。
大腸菌を使うことで、これまで高価だった検査薬を安価で大量生産することができるようになり、あらゆる病気の検査に迅速に対応することができるようになります。そこで、ここでは大腸菌で抗体を作るプロセスについて紹介したいと思います。
以下の図解をご覧ください。
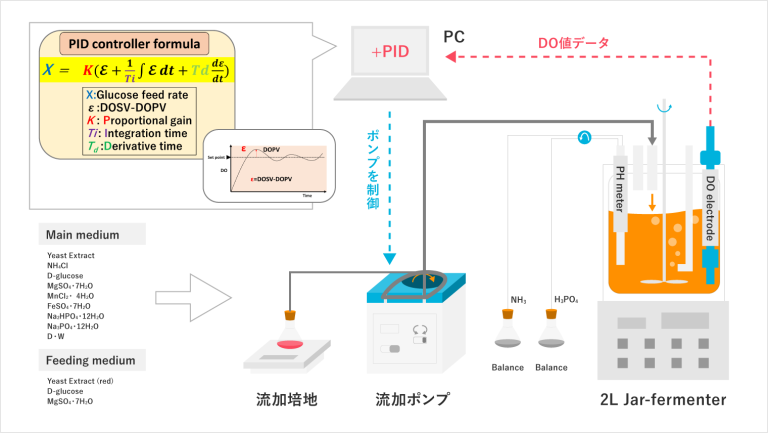
これは、大腸菌を使って抗体を作るプロセスの一連を図解にしたもので、右上にあるタンクの中で大腸菌が培養され抗体が作られます。
手順としては、
①抗体の遺伝子を大腸菌に導入する
②その大腸菌を高密度培養する
③遺伝子が発現し抗体が生み出される
この3つのプロセスに沿って抗体を作っていきます。では「このプロセスを辿れば誰でも抗体が簡単にできるのか」というと、そうではありません。
タンク内で増殖している大腸菌は、少しの環境変化ですぐに死滅してしまうので、タンク内の状況をしっかり監視しながら24時間休まず世話をしてやる必要があります。培養の状況によっては、100時間(約4日間)もの間、監視を続ける必要があります。
人間でも、赤ちゃんの時は24時間休むことなく親が子供を観察して世話をする必要がありますが、まさにその状態だと言えます。
たとえば、大腸菌はタンク内に供給される何種類もの栄養源を食べながら増殖するのですが、培養を続けていくとタンク内の栄養源の1つが不足してしまいます。不足した栄養源はすぐにタンク内に供給しないと大腸菌は死滅し、その結果、抗体の生産も停止してしまいます。また、抗体生産には、酸素の供給も重要です。大腸菌の増殖が活発になるとタンク内の酸素がなくなり、酸欠状態になります。ですので、少しでも酸素が減った場合は、すぐに酸素をタンクに送り込まないと、タンク内にタンパク質を分解する酵素(プロテアーゼ)や有機酸などが発生するなど様々な要因で死滅してしまいます。
では最初からたくさんの栄養源などをタンク内に入れておけば良いのか、というとそうではありません。一度に大量の栄養源をタンク内に入れてしまうと、大腸菌は、一度に大量の栄養源を食べてしまい、急激にタンク内が酸欠状態となり、その結果死んでしまいます。
つまり、タンク内の栄養源の濃度や酸素濃度を一定に保つために、常に微調整してやる必要があるということです。これを叶えるために開発したシステムが最初にお見せした図解(図4 組換え大腸菌のタンク培養システム)です。タンク内に設置された様々なセンサーが溶存酸素の濃度や温度,pHを計測し、そのデータを24時間コンピュータにフィードバックしています。
そして、そのフィードバックをもとに、コンピューターが適切な量の栄養源や酸素をタンク内に送り続けます。そうすることで長時間に渡り大腸菌を培養し続けることが可能となるのです。
その結果、100時間以上、大腸菌を培養し続けることができ、1L当り5.5gという大量の抗体を生み出すことに成功しました。通常1gあれば、一年分の検査薬を作れると言われる世界で、たった100時間で5.5gをしかも安価で製造できるのです。
この技術があれば、病気で困っているあらゆる人たちの役に立つことができると考えています。
現在、私は、どんな抗体であっても同じ結果を得られるように、抗体ごとに、適したタンク培養法を研究し、その研究をまとめています。
リフォールディングで抗体を再生させる方法
上記の高密度培養で大方の抗体は大量生産可能なのですが、中にはどうしても活性のある状態で大量生産できない抗体も一部存在します。そのような、不安定な抗体を大腸菌で作ろうとした場合、その抗体は封入体(インクルージョンボディ)とよばれる凝集体として回収されます。
抗体は水に溶けているのが理想の状態ですが、封入体となった抗体は、水に溶けずに構造が崩れて粉状になってしまいます。特に天然には存在しない、ペプチドタグを導入した「タグ付き抗体」を生産する過程でよく見られます。
「タグ付き抗体」が、元々自然界にない新しいタンパク質であるため、当然の結果と言えるでしょう。ですが、本当に実用化を目指すのであれば、ペプチドタグを加えた抗体の製造は必須であり、この課題をクリアしない限り先に進むことができません。
そこで活用するのがリフォールディングという技術です。

上記の写真のように粉状になってしまった抗体の使い道は一見なさそうに見えますが、実は、リフォールディング技術を使うことで、抗体の形を再生することができるのです。
粉状になった封入体は、形が崩れて、そのまま固まった状態となっています。そこに変性剤を入れることで、崩れて固まったタンパク質をほぐすことが可能になるのです。そして、ほぐした後に変性剤を取り除くことで、元の抗体の形に戻っていき正しい構造を再生することができるのです。
これがリフォールディング技術です。
これまで、このリフォールディングを使って、様々な抗体を再生している最中にいくつもの面白い発見がありました。たとえば、リフォールディングを促進する効果をもつペプチドタグが存在していることです。
ペプチドタグは、固定化のために我々が発見したものですが、研究をするなかで、「リフォールディングを促進する効果も併せ持つペプチドタグ」が存在していることがわかりました。
通常であればリフォールディングするのが困難な抗体であっても、このペプチドタグを導入することで、リフォールディングが促進され、抗体を再生することができます。ですので、最初からリフォールディングで作った方が良い抗体も多く存在しています。このような新しい発見と出会えるのも抗体研究の醍醐味といえるでしょう。
以上が、抗体を作る方法になり、まとめると以下の3つの方法で抗体を生み出すことができるということになります。
1. 大腸菌をタンク培養して抗体を作る方法
2. リフォールディングで抗体を再生させる方法
大腸菌で抗体を作ると言っても、その手法はとても奥が深く、そして、古いようで新しく、まだまだ未知な部分もたくさんあります。私の役割は、この未知な部分にスポットライトを当て、検査薬として有効に機能する抗体を可能な限り安く、大量に作り出すことだと考えています。
分野、時間、あらゆる垣根をこえてプラットフォームは進化する
低コストかつ精度の高い抗体を作ることは、私のライフワークであり、これからも続けていきますが、目指すゴールはその先にあります。研究の先に見据えているのは、『誰もが活用できる技術のプラットフォーム化』です。
このプラットフォームにアクセスすれば、誰でも検査薬に適した抗体の作り方が分かり、迅速に必要な検査薬を必要な量だけ安価に作ることができる、という状態です。
それは、料理レシピが網羅された本やサイトなどのプラットフォームのようなイメージかもしれません。
使用する食材や器具について深い知識がなくても、そこに書かれている分量や手順をしっかりと守ることで、誰でも料理が作れるように、抗体の技術に詳しくない研究者であっても、そのプラットフォームにあるメソッドや技術を活用することで、理想の抗体を作ることができるようになります。
このプラットフォームには、それぞれの病気に応じた抗体の作り方はもちろん、抗体の選び方、大腸菌の培養方法からペプチドタグの作り方、材料基板について全てが網羅されています。
また、そのプラットフォームがあらゆる方々にシェアされて行くことで、新たな課題も見つかっていくでしょう。この課題こそが、更なる未来を作る重要なヒントになると考えています。生まれた課題を解決し、それさえもそのプラットフォームに追加していくことで、さらに進化していきます。
また、抗体という分野の垣根を超えて、様々なテクノロジーがこのプラットフォームに集まってくることを望んでいます。私の研究の最終地点は「理想の抗体を作る」ことではなく、その先にある「理想の検査薬を作る」点にあるからです。理想の検査薬を作るということを目的とした場合、取り組むべき課題は、抗体だけではありません。
検査薬を作るという過程において、そこにはあらゆる分野の研究が関わっているからです。
それらの研究結果も、このプラットフォームに置くことで、誰もが理想の検査薬を作ることができ、世の中に浸透してくのではないでしょうか。
私の抗体研究を違う分野の研究者の方が活用してくれたり、私も研究する上で別の研究者の技術を活用することも大いにあるでしょう。そうやって検査薬における研究は盛んになっていくと考えています。そして、このプラットフォームは、私たちがいない次の時代になっても残り続け、別の研究者が新しいメソッドを追加しながらより発展していくことを願っています。
少し、大きな話に聞こえるかもしれませんが、私が今抗体の研究をしているのは、このプラットフォームを実現するためだと確信しています。そのためには、まずは私が研究している抗体が、世の中でどんどん実用化されることが大切であると考えています。研究だけではなく、実用化に向けた普及活動にも力を入れていく所存です。
研究者プロフィール

主な発表論文・関連特許
Strategies for selection and identification of rabbit single-chain Fv antibodies as ligand in affinity chromatography
著者名 : Y. Kumada*, H. M. Rakotondravao, Y. Hasegawa, Y. Iwashita, H. Okura,S. Uchimura, J. Horiuch
掲載誌名 : Journal of Bioscience and Bioengineering
出版年月 : 2022年09月
巻・号・頁 : 134, 233-239
Efficient and robust isolation of rabbit scFv antibodies using antigen-coupled multilamellar vesicles
著者名 : Yoichi Kumada, Yuya Hasegawa, Jun-ichi Horiuchi
掲載誌名 : Journal of Bioscience and Bioengineering
出版年月 : 2021年03月
巻・号・頁 : 131(3), pp. 299-304
Design and site-directed immobilization of single-chain Fv antibody to polystyrene latex beads via material-binding peptides and application to latex turbidimetric assay
著者名 : Yoichi Kumada, Yohei Miyamura, Reina Tanibata, Koichi Takahashi,Shinya Ogasawara, Fumio Gondaira, Jun-ichi, Horiuchi
掲載誌名 : Journal of Bioscience and Bioengineering
出版年月 : 2021年01月
巻・号・頁 : 131(1), 84-89
Site-Specific Immobilization of Recombinant Antibody Fragments through Material-Binding Peptides for the Sensitive Detection of Antigens in Enzyme Immunoassaysssay
著者名 : Y. Kumada
掲載誌名 : Biochimica Biophysica Acta
出版年月 : 2014年07月
巻・号・頁 : 1844・pp.1960-1969
- 産学連携や研究支援に興味がある方(産学公連携推進センターHP)
- 紹介教員にメッセージを送りたい方(メッセージフォーム)
- 大学や学生を支援したい方(基金事業)
- 受験を考えている方(入試情報)
- 大学全体について知りたい方(京都工芸繊維大学HP)




